Los defectos de Schottky y Frenkel son las dos subcategorías cruciales de defecto puntual. La diferencia significativa entre el defecto de Schottky y el de Frenkel es que el defecto de Schottky surge cuando faltan átomos (que consisten tanto en cationes como en aniones) en la red cristalina. Por el contrario, el defecto de Frenkel surge cuando un ion más pequeño (en general, un catión) se disloca de su posición real a un sitio intersticial.
En el defecto de Schottky, existe la vacante combinacional de catión y anión dentro de la red cristalina. Como faltan tanto el catión como el anión, la electroneutralidad general del cristal permanece inalterada. Sin embargo, este no es el caso con el defecto de Frenkel ya que aquí el ion más pequeño se dislocó a otra ubicación dentro del cristal.
Antes de conocer en detalle las diferencias entre los dos, primero tengamos una idea básica sobre
¿Qué es un defecto?
El defecto en los sólidos, en general, corresponde a las irregularidades en las partículas constituyentes que forman la estructura cristalina. Generalmente, un átomo faltante o una impureza en lugar del átomo real conduce a un defecto en el sólido. Debe notar aquí que el comportamiento físico y químico de los sólidos varía con el defecto presente en ese material sólido en particular.
Como hemos discutido, los defectos de Schottky y Frenkel son parte del defecto puntual. Básicamente, un defecto puntual es un error en el sitio atómico en un cristal. A veces, esto puede ser en forma de un átomo faltante que representa una vacante, mientras que a veces los átomos se desplazan del sitio correcto a una ubicación que generalmente permanece desocupada y esta ubicación se denomina sitio intersticial.
Índice de contenidos
Gráfica comparativa
| Básico | Esto surge cuando los cationes y los aniones están ausentes de sus respectivos sitios de red. | Esto surge cuando los cationes dejan su lugar respectivo en la red y se trasladan a un sitio intersticial. |
| Defectos asociados | Defecto de vacante | Defecto de vacante en el punto actual y defecto intersticial en la nueva ubicación. |
| Generalmente visto en | Sólidos iónicos que tienen tamaños catiónicos y aniónicos comparables. | Sólidos iónicos que tienen una gran diferencia en tamaño de catión y anión. |
| Desplazamiento | Tanto el anión como el catión salen del cristal. | Aquí, aunque se produce un desplazamiento, ningún ion se desplaza fuera del cristal. |
| Densidad cristalina | Disminuye | Sin efecto |
| produce | Dos vacantes, una de catión y otra de anión. | Una vacante y un sitio intersticial. |
| Ejemplo | NaCl, KCl, CsCl, etc. | Agbr, AgCl, ZnS, etc. |
Definición de defecto de Schottky
El defecto de Schottky es un defecto de vacante exhibido por sólidos iónicos. En este defecto, los iones del sólido (tanto cationes como aniones) dejan su lugar vacante y se alejan de la red cristalina. Esto crea una vacante dentro de la estructura cristalina. La siguiente figura representa el defecto de Schottky:
Está claro a partir de la figura que se muestra arriba que en el sólido cristalino, en algunos puntos hay una vacante iónica. Puede ver claramente que los iones que han dejado sus lugares no se desplazan a ningún espacio vacío dentro de la red. Esto da como resultado una disminución en la densidad total del material.
Definición de defecto de Frenkel
El defecto de Frenkel a veces se denomina defecto de dislocación y es una combinación de vacante y defecto intersticial. En este defecto, los cationes dejan su posición actual dentro de la red y ocupan un espacio vacío dentro de la red, generalmente conocido como sitio intersticial. La siguiente figura muestra el defecto de Frenkel: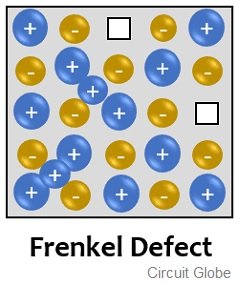
De la figura dada arriba, podemos decir que aquí el catión ha dejado su posición original que está vacante y se ha desplazado al espacio que no está ocupado por un ion dentro de la propia red cristalina.
Diferencias clave entre el defecto de Schottky y el defecto de Frenkel
- los factor clave La diferenciación entre el defecto de Schottky y el de Frenkel está relacionada con el movimiento de los iones dentro o fuera de la red cristalina. El defecto de Schottky es el resultado del movimiento de un átomo fuera de la red cristalina. Mientras que el defecto de Frenkel es el resultado del desplazamiento de iones desde el sitio real a un espacio vacío dentro de la red cristalina.
- Como en el defecto de Schottky, los iones se mueven fuera del cristal, por lo tanto, el total densidad cristalina muestra reducción debido a este defecto. Sin embargo, en el defecto de Frenkel, como los iones solo se desplazan a una nueva ubicación pero no salen del cristal, su densidad cristalina permanece igual.
- El defecto de Schottky es prominente en aquellos sólidos en los que la diferencia en el tamaño del catión y del anión no es mucha. Por el contrario, el defecto de Frenkel lo muestran los sólidos que poseen una gran diferencia en el tamaño del catión y del anión.
- Un defecto de Schottky muestra dos vacantes en la estructura cristalina del sólido donde una vacante corresponde al catión y la otra corresponde al anión. Por otro lado, el defecto de Frenkel representa una única vacante en el sitio real del ion, ya que ese ion ocupa otro espacio vacío en la red cristalina.
- Un conocido físico alemán Walter H. Schottky explicó el defecto de Schottky. Mientras que el defecto de Frenkel fue propuesto por un físico soviético Yakov Frenkel.
- Los sólidos cristalinos como el cloruro de sodio, el cloruro de potasio, el cloruro de cesio, etc. presentan un defecto de Schottky. Mientras que los sólidos cristalinos como el cloruro de plata, el bromuro de plata y el sulfuro de zinc, etc. muestran el defecto de Frenkel.
Conclusión
La discusión anterior concluye que tanto los defectos de Schottky como los de Frenkel están asociados con un sólido cristalino y provocan una vacante en el sitio real. Pero la diferencia está en el defecto de Schottky, los iones abandonan la red cristalina por completo, pero en el defecto de Frenkel, los iones toman un sitio intersticial dentro de la red.
Un bromuro de plata sólido cristalino (AgBr) es el que muestra tanto el defecto de Schottky como el de Frenkel.